Mit Hilfe der Manganometrie kann man durch (sog. Redox-)Titration die Konzentration reduzierender Substanzen bestimmen.
Die Bestimmung des Endpunktes der Titration ist einfach, da Permanganat stark gefärbt ist und bei Reduktion in eine farblose Lösung übergeht. Es ist daher kein Indikator notwendig, der Endpunkt der Titration ist erreicht, wenn die Violettfärbung in der Lösung nicht mehr verschwindet.
Bestimmung von Fe2+ in einer Fe(II)-sulfatlösung unbekannter Konzentration
Verwendete Geräte
Bürette, Pipette (10 ml), Titrierkolben
Verwendete Chemikalien
- KMnO4 (0.2 mol/l)
- FeSO4 (Konz. unbek.)
- Schwefelsäure: H2SO4, konz.
Durchführung
Herstellung der Permanganatlösung
 3.16 g KMnO4 werden in einen Maßkolben eingewogen in 100 ml Wasser gelöst.
3.16 g KMnO4 werden in einen Maßkolben eingewogen in 100 ml Wasser gelöst.
10 ml Eisensulfatlösung (Konzentration unbekannt – eingewogen wurden etwa 2,9 FeSO4 . 7 H2O in ca. 100 ml Wasser) in den Titrierkolben geben und langsam (unter Schütteln) 1 ml konzentrierte Schwefelsäure zufügen.
Die Bürette wird mit KMnO4-Lösung gefüllt. Nun wird bis zu einer schwachen Rosafärbung titriert.
Die Titration wurde 2x durchgeführt, der Äquivalenzpunkt war bei 3.2 ml Permanganatlösung erreicht.
Aufgaben
- Stelle die Redoxgleichung für die Oxidation von Fe(II) zu Fe(III) mit Hilfe von KMnO4-Lösung auf.
Antwort:
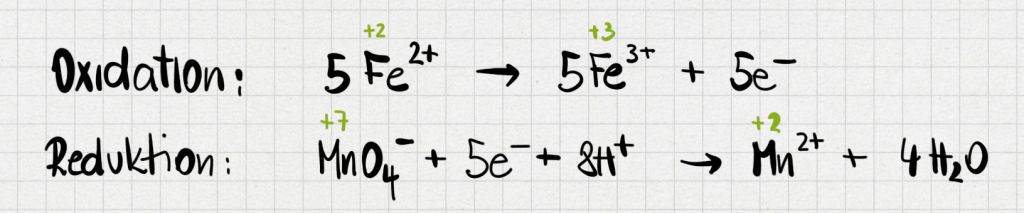
- Berechne die Konzentration der Fe(II)-Ionen in der Lösung unbekannter Konzentration.
Antwort:
